L’ammoniac liquide : un carburant vert pour le secteur du transport ?

L’ammoniac est la seconde molécule la plus produite (en terme de volume annuel) par les industries chimiques. Cette molécule-clé, présentant des applications majeures dans le secteur de l’agriculture, a également la capacité de pouvoir stocker l’énergie (en particulier l’hydrogène). Qui plus est, l’ammoniac sous forme liquide peut également servir de carburant pouvant se substituer au LPG d’origine fossile.
N’étant pas carboné, l’ammoniac exploité comme combustible n’émet donc pas de CO2 dans sa phase d’usage. Pour cette raison, il apparait comme une solution stratégique dans le secteur du transport maritime et aérien en replacement, respectivement, des fuels lourds et du kérosène.
Si ces arguments semblent si bénéfiques et indiscutables, diverses questions méritent cependant d’être soulevées. A l’heure actuelle, l’ammoniac est produit au départ de ressources fossiles. Est-il donc techniquement envisageable de produire cette molécule à partir de ressources renouvelables ? L’ammoniac est-il vraiment le « carburant du futur » comme le prônent certains industriels ?
S’oriente-t-on vers une « économie de l’ammoniac » ? C’est la question à laquelle je vous réponds aujourd’hui.
Prélude
L’ammoniac est une molécule de formule chimique NH3 qui se présente sous la forme d’un gaz à température ambiante et à pression normale. Il peut également être stocké sous une forme liquide à basse température (sous -33°C) et/ou lorsqu’il est comprimé. Dans ce cas, on parle d’ammoniac liquide.
L’ammoniac est une base, irritante tant pour la peau que pour les voies respiratoires, qui possède une odeur spécifique détectable dans l’air à des doses de quelques ppm seulement. Ce gaz est fortement soluble dans l’eau avec des solubilités qui diminuent avec l’augmentation de la température (la solubilité dans l’eau passe ainsi de 89,9 g NH3/100 g d’eau à 0°C à 7,4 g NH3/100 g d’eau à 96°C). Quand l’ammoniac est solubilisé dans l’eau, on a donc une solution d’ammoniac aqueux, qui prend ainsi le nom d’ammoniaque (NH4OH).
L’ammoniac tire son nom du dieu Ammon et plus spécifiquement des morceaux de « salammoniac » (aussi appelé « sal » ou « sel » ammoniac), un minerai présentant une odeur typique et composé de chlorure d’ammonium (NH4Cl) collecté par les Romains aux abords du temple de Jupiter-Ammon en Libye antique. Depuis l’Antiquité, les hommes avaient ainsi conscience de l’existence de cette molécule, et de ses caractéristiques « olfactives ». Molécule emblématique de certaines approches alchimiques, il faudra cependant attendre 1785 et les conclusions du chimiste Français Berthollet devant l’Académie des Sciences pour comprendre la composition centésimale de cette molécule et établir qu’elle était composée d’un atome d’azote sur lequel se fixe trois atomes d’hydrogène. [1] Le connaissances relatives à l’ammoniac vont par ailleurs progressivement s’étoffer vers la moitié du 19ème siècle avec la découverte et la description du cycle de l’azote. C’est à cette période que l’ammoniac se dévoile comme un constituant de choix pour la formulation d’engrais azotés et que la question de la production à grande échelle de cette molécule commence à se poser.
Abondance naturelle et synthèse industrielle
L’ammoniac est omniprésent dans les atmosphères et les sols de nombreuses planètes (et satellites) de notre système solaire, que ce soit sous forme gazeuse ou solide.[2] Une étude parue au mois d’août 2020 décrit ainsi la présence sur Jupiter de violents orages générant des grêlons d’ammoniaque.[3] Sur Terre, par contre, il n’est détecté qu’à l’état de traces, majoritairement issu de matières animales ou végétales ou par des émissions anthropiques via le secteur industriel. On retrouve cependant l’ammoniac dans les couches terrestres profondes, piégé sous la forme de sels, de même que dans certaines roches ou matières organiques fossiles.[4] L’ammoniac est aussi détecté dans les pluies, certaines régions volcaniques, de même que dans les sols fertiles.
Jusqu’au 19ème siècle, l’ammoniac était produit par distillation de purin et de fumier ou par extraction des eaux-vannes domestiques. Il est ensuite obtenu après la seconde moitié du 19ème siècle comme sous-produit de l’industrie du gaz manufacturé (gaz de ville).[5] Il faudra ainsi attendre le début du 20ème siècle (1909-1913) pour voir se développer une production industrielle massive d’ammoniac via le procédé Haber-Bosch, un des procédés les plus efficaces (toutes catégories confondues) de l’industrie chimique et toujours exploité de nos jours.
Le procédé Haber-Bosch, d’une portée économique considérable, combine quantitativement deux gaz (hydrogène H2 et azote N2) typiquement à des pressions comprises entre 100 et 300 bars, et des températures de l’ordre de 300-550°C en présence d’un catalyseur à base de fer (Fe3O4) (Figure 1). La réaction est exothermique, ce qui signifie qu’elle dégage de l’énergie sous forme de chaleur. En fin de procédé, l’ammoniac est séparé de H2 et N2 (qui sont réinjectés dans le procédé) par liquéfaction et stocké.
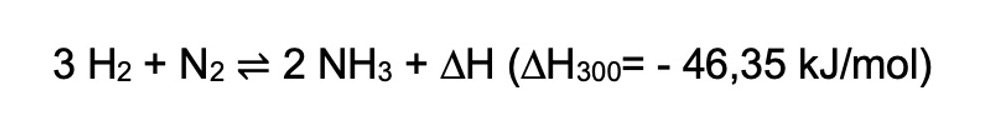
L’azote (N2), un des intrants de ce procédé, est fixé par voie catalytique à partir de l’air atmosphérique. Quant à l’hydrogène (H2), il est obtenu en amont à partir de reformage catalytique de gaz naturel (méthane).
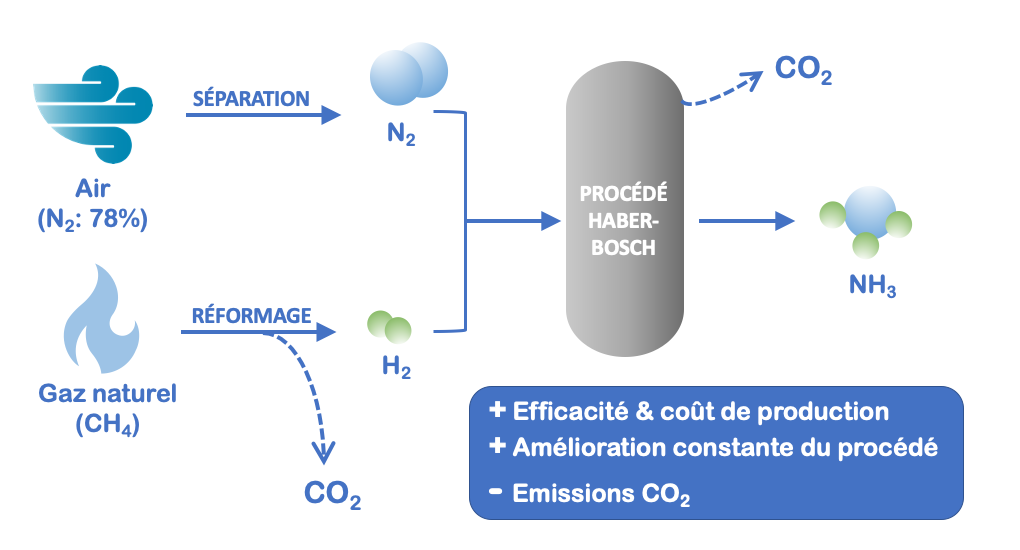
Figure 1. Schématisation du procédé Haber-Bosch
Selon l’Institute for Industrial Productivity’s Industrial Efficiency Technology Database, la production industrielle d’ammoniac culminait à plus de 164 millions de tonnes en 2011, correspondant à une production journalière de près de 450 000 tonnes. La production est par ailleurs en augmentation depuis plus de 20 ans avec un volume annuel qui a grimpé de 25% entre 2000 et 2010. La plus grande progression est notée en Chine sur les 15 dernières années (65%) au même titre que dans des pays comme l’Inde, la Russie, ou même Trinidad et Tobago. Le marché de l’ammoniac est fragmenté avec différents acteurs occupant la part de marché. La croissance du marché est d’environ +2% pour la période 2019-2023.[6]
Entre 75 et 90% de la production annuelle en ammoniac sont destinés au secteur des fertilisants (il est estimé que plus de 50% de la production alimentaire repose sur des engrais dérivés de l’ammoniac).[7] Les 10-25% restants se répartissent notamment entre les secteurs pharmaceutique, textile, de la chimie fine et de la plasturgie.
Si le procédé Haber-Bosch représente l’un des procédés les plus efficaces et performants de l’industrie chimique, il est cependant à mentionner qu’il consomme (en raison des hautes pressions et températures requises pour la réaction) à lui seul près de 1% de la production énergétique mondiale ! Ce procédé représenterait ainsi plus de 17% de l’énergie consommée par le secteur chimique et pétrochimique. En 2004, il a été établi que la production de NH3 a usé plus de 5,6 EJ de combustibles fossiles dont 2,9 EJ concerne le gaz naturel utile à la production de H2 et 2,7 EJ pour le procédé de synthèse en lui-même. Qui plus est, l’empreinte carbone globale du procédé est défavorable, avec des émissions concomitantes de CO2 (la génération de H2 par reformage cause plus de 50% des émissions carbone sur l’ensemble de la chaine de production de l’ammoniac). On estime ainsi que pour chaque molécule de NH3 produite, une molécule de CO2 est émise sur l’ensemble de la chaine de production.
Vers une production industrielle d’ammoniac à moindre empreinte carbone ?
Conscients des projections sans cesse à la hausse de la demande en ammoniac, et des problématiques environnementales associées à sa production industrielle, les chercheurs (académiques et industriels) privilégient des améliorations constantes du procédés et des voies plus innovantes de production.
L’utilisation de ressources renouvelables comme intrants dans les schémas de production pourrait offrir une solution à court ou moyen terme, par exemple en exploitant l’électrolyse de l’eau comme procédé de production de H2. L’exploitation d’énergie solaire (panneaux photovoltaïques) permettrait à elle seule de diminuer de plus de 50% les émissions de CO2 associées à la production de NH3 par le procédé Haber-Bosch (Figure 2). Une unité pilote de ce type est actuellement en phase d’évaluation par Yara (société internationale produisant et distribuant des dérivés azotés dont des engrais), en Australie.
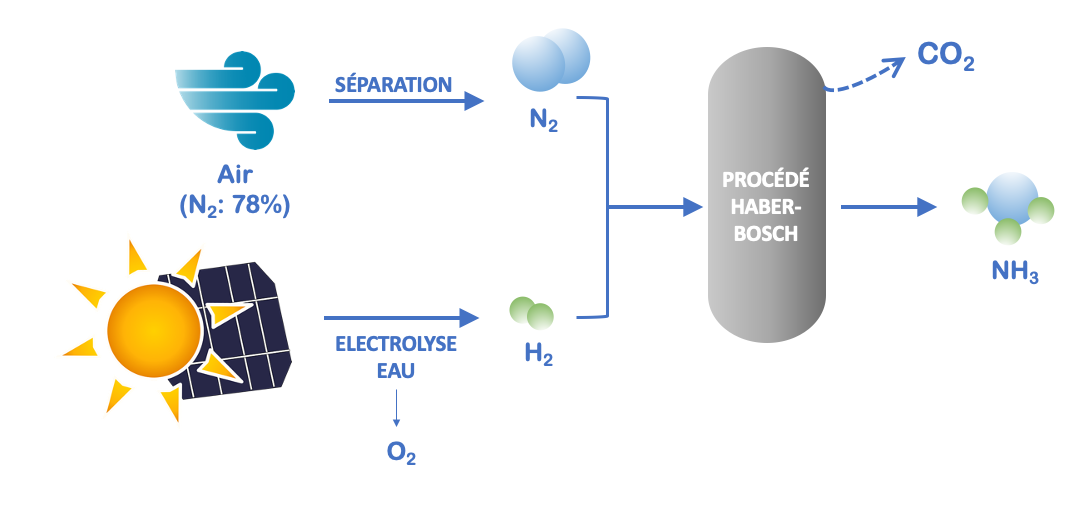
Figure 2. Amélioration du procédé de production de l’ammoniac par utilisation de sources d’énergies renouvelables.
D’autres voies de rupture sont aussi à l’étude, envisageant une approche de production par électrolyse et combinaison à basse pression et basse température de H2 et N2, le tout alimenté par l’énergie solaire et l’énergie éolienne (Figure 3).[8]
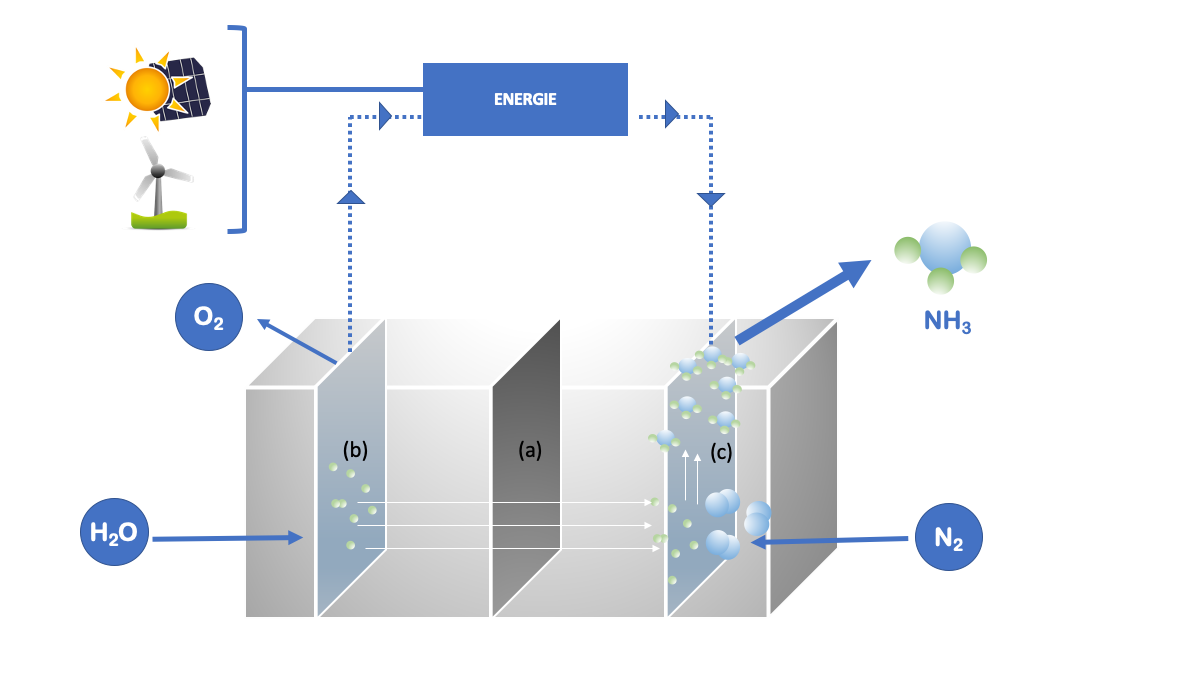
Figure 3. Production alternative d’ammoniac à basses T° et pression au sein d’une unité d’électrolyse alimentée par des énergies renouvelables. (a) = membrane de séparation ; (b) = anode ; (c) = cathode. Les flèches en pointillés indiquent le chemin des électrons au sein du dispositif.
Il est cependant à noter que les usines manufacturant de l’ammoniac tirent parti des émissions concomitantes de dioxyde de carbone qu’ils exploitent en effet pour produire de l’urée (CO(NH2)2), une molécule dont la production annuelle s’élève à plus de 120 millions de tonnes. C’est ce qu’on appelle de l’intégration, c’est-à-dire combiner ou tirer profit de productions chimiques sur un même site. L’urée est synthétisée par réaction entre l’ammoniac et le CO2 à haute pression (Figure 4). L’urée est principalement destinée à l’agriculture tant comme engrais que comme additif pour l’alimentation animale.
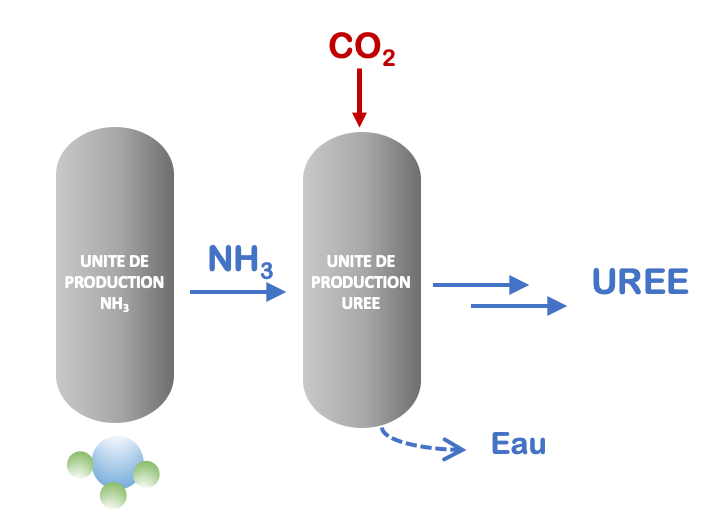
Figure 4. Illustration sommaire de la production intégrée d’urée
L’ammoniac liquide : des propriétés de stockage et d’usage compétitives ?
Avec une production industrielle efficace, en constante amélioration, et avec une réflexion de plus en plus ancrée sur l’usage de ressources renouvelables pour diminuer l’empreinte carbone du procédé, l’ammoniac est une molécule qui se profile de plus en plus comme un enjeu stratégique dans le secteur de l’énergie soit directement liquéfié pour des applications comme carburant dans des moteurs à combustion interne, soit comme vecteur permettant le stockage d’hydrogène.[9]
L’ammoniac liquide peut donc ainsi être utilisé comme carburant pour le transport mais aussi comme combustible pour le chauffage (domestique ou industriel). L’ammoniac peut être fractionné par générer de l’hydrogène applicable dans des piles à combustible et autres applications ciblées en lien avec le transport ou la production de chaleur et d’électricité.
La combustion de l’ammoniac génère uniquement de l’eau et de l’azote (N2) (et de la chaleur).
![]()
L’ammoniac ne produit donc aucune émission carbonée (CO2) comme c’est d’ordinaire le cas avec d’autres carburants fossiles liquides (hydrocarbures). L’émission d’oxydes d’azote (NOx) est reportée dans certaines conditions d’usage, mais ces informations restent lacunaires et se doivent d’être mieux documentées et anticipées.
L’ammoniac liquide possède une densité énergétique volumique de 11,5 MJ/L, ce qui est environ 3 fois moins que le diesel, ou deux fois moins que l’éthanol (un biocarburant additionné à l’essence) (Figure 5). L’ammoniac liquide est ainsi plus compact que certains autres carburants « traditionnels » comme l’essence ou le kérosène ou certains « biocarburants » comme l’éthanol ou le butanol. Il est également facilement stockable sous forme liquide (bien plus que l’hydrogène). Sa température d’ébullition (Te) et sa pression de condensation (Pc) sont proches de celles du propane (employé comme LPG – Liquefied Petroleum Gas – dans le transport) (Te NH3 = -33,4°C à 1 atm contre -42,1°C pour le propane ; Pc NH3 à 25°C = 9,9 atm contre 9,4 pour le propane). Cette analogie permettrait donc de pouvoir utiliser, pour l’ammoniac liquide, les infrastructures de transport et de stockage déjà en place pour le LPG (navires de transport, réservoirs de stockage, pipelines, structures de distribution).
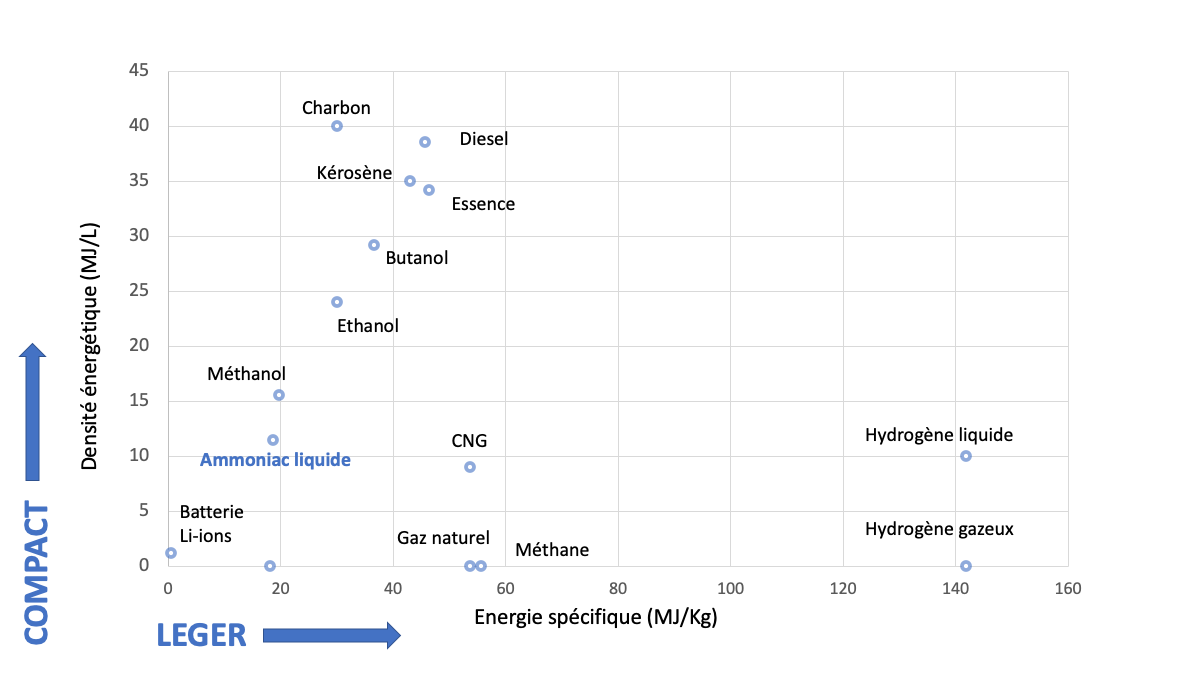
Figure 5. Densité énergétique de quelques produits (solides, liquides ou gazeux).
L’ammoniac présente cependant une toxicité avérée, plus importante que d’autres combustibles classiques. Il est cependant moins inflammable, et présente donc moins de danger d’explosion que le gaz naturel comprimé (CNG), le méthanol, l’essence, l’hydrogène ou le LPG (Figure 6).
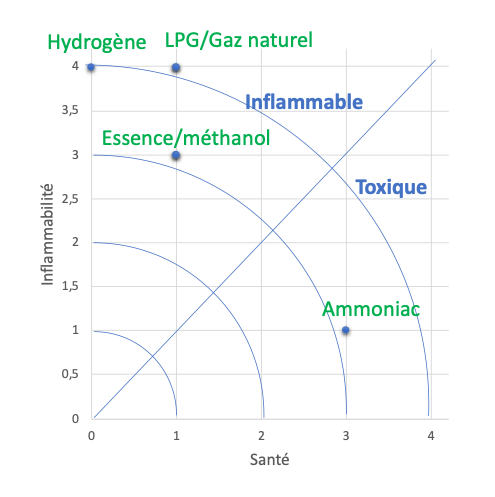
Figure 6. Relation toxicité vs. Inflammabilité de divers carburants. 0 = risque nul, 4 = risque sévère.
Une utilisation « en l’état » dans des moteurs à combustion
L’usage de l’ammoniac comme carburant n’est pas récente. Il était déjà exploité depuis le début du 19ème siècle comme carburant dans des engins motorisés, notamment dans des locomotives (Angleterre) ou dans des tramways (Nouvelle Orléans*/*, USA). Pendant la seconde guerre mondiale, la Belgique (alors victime d’un embargo sur le diesel) décida même d’alimenter ses bus à l’ammoniac liquide. Dans le courant des années 60, l’ammoniac fut également envisagé dans des moteurs alternatifs, notamment pour des usages militaires. L’ammoniac a été utilisé comme agent de propulsion pour certains avions fusées dans les années 50-60 dans le cadre d’une série de missions suborbitales.
Plus récemment, l’ammoniac est revenu sur le devant de la scène afin de « décarboner » divers secteurs spécifiques, principalement le secteur du transport maritime en remplacement de certains fuels lourds (type HFO), connus pour leurs émissions contributives en gaz à effet de serre.[10] Générant moins de risque que l’hydrogène lors des opérations de stockage, émettant moins de gaz à effet de serre que le LPG ou le CNG, l’ammoniac est donc un carburant envisagé comme économiquement viable pour le secteur du transport maritime. Néanmoins, son impact environnemental global (depuis sa phase de production à sa phase d’usage) se doit d’être évalué au cas par cas. En effet, le transport de l’ammoniac depuis sa zone de production jusqu’aux zones portuaires se doit d’être le plus court possible (en terme de distance). Diverses initiatives de démonstration du potentiel de l’ammoniac dans le secteur maritime se mettent progressivement en place, notamment aux Pays-Bas.[11]
L’efficacité de l’ammoniac dans des moteurs à combustion interne est améliorée lorsque celui-ci est mélangé avec d’autres carburants. L’ammoniac possède en effet une faible vitesse de flamme et une grande résistance à l’auto-inflammation. Le dopage de l’ammoniac avec d’autres carburants fossiles (notamment le diesel) offre l’option la plus performante d’un point de vue technique, réduisant par ailleurs les émissions en CO2 et en NOx si le pourcentage en NH3 dans le mélange n’excède pas 60% en poids. Des mélanges de type essence/NH3 ou éthanol/NH3 offrent aussi une puissance de sortie élevée dans des conditions stables, bien que principalement conditionnée par des émissions de NOx lors des phases de combustion.
Un vecteur énergétique pour le stockage d’hydrogène
L’ammoniac permet aussi de stocker l’hydrogène. Le pourcentage massique en hydrogène dans l’ammoniac est assez haut (17,6%) comparativement à d’autres solutions de stockage telles que le méthanol (12,5%).[12] Cependant, pour produire de l’hydrogène (H2) à partir d’ammoniac, par des opérations de craquage, un apport énergétique externe important est requis, de même que des réacteurs (ou réservoirs embarqués sur les véhicules) de très grande capacité. Le sous-produit de la décomposition de NH3 en hydrogène est de l’azote (N2) pouvant être émis dans l’atmosphère sans le moindre risque environnemental.
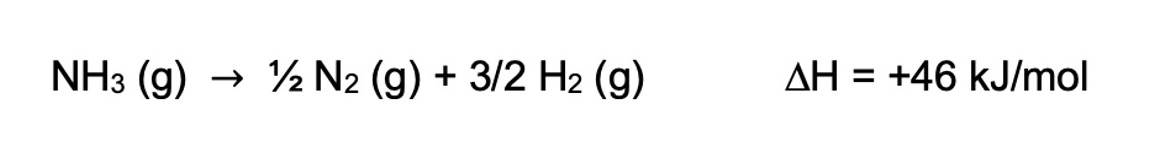
La réaction de décomposition de l’ammoniac est endothermique, ce qui signifie que des apports thermiques importants (> 600°C) sont requis, en présence d’un catalyseur (souvent à base de nickel). Ces T° sont bien supérieures aux T° de fonctionnement des piles à combustible à membrane d’échange de protons. Le % en NH3 non converti à 1 bar passe ainsi de 0,88% à 400°C, à 0,10% à 600°C et devient négligeable aux alentours de 900°C (0,015%). Les membranes actuelles des piles à combustible étant sensibles aux traces résiduelles d’ammoniac, il est donc logique de privilégier des T° de décomposition les plus hautes possibles. Le choix des matériaux pour la fabrication des réservoirs embarqués sur véhicule est donc capital, permettant de résister aux hautes variations de T° appliquées (de la T° ambiante quand le véhicule n’est pas utilisé aux T° requises pour la production d’hydrogène). Par ailleurs, le matériau doit pouvoir supporter des variations de pression, de même qu’être résistant à la corrosion.
L’usage d’ammoniac comme vecteur d’hydrogène dans des réservoirs embarqués est ainsi soumis à certaines contraintes (techniques et sécuritaires) de même qu’à des verrous technologiques qui se doivent encore d’être levés par les chercheurs. Il est ainsi important d’accroitre les aspects de sécurité liés à l’usage d’ammoniac (rappelons que l’ammoniac est toxique). Par ailleurs, le design de nouveaux catalyseurs permettant d’améliorer la conversion de l’ammoniac en hydrogène à plus basse température se doit d’être étudié.
Conclusion : se dirige-t-on vers une « économie de l’ammoniac » ?
L’ammoniac est une production forte du secteur chimique. Son coût de production (en euros/tonne) est cependant dépendant du prix du gaz naturel (matière première).[13] De manière simplifiée et prospective, pour un prix du gaz naturel passant de 1,5 USD/million de BTU (prix février-mars 2020) à 4,1 USD/million de tonne BTU (novembre 2018)[14], le prix de l’ammoniac oscille ainsi entre 25USD/tonne et 120 USD/tonne. Une augmentation du prix du gaz naturel à 10,5 USD/million de BTU entrainerait un prix de 377 USD/tonnes pour l’ammoniac, ce qui offrirait un prix marché de H2 à plus de 3 USD/kg (en prenant une efficacité de 75% pour le craquage NH3-H2). L’intérêt de la transition vers des ressources renouvelables comme intrants dans les schémas de production et/ou comme source d’énergie est donc un enjeu stratégique considérable dans le déploiement de l’ammoniac comme molécule de choix dans le secteur de l’énergie.
Le Japon a été un des premiers pays à s’intéresser à l’ammoniac comme vecteur de stockage d’hydrogène.[15] Le Programme « Green Ammonia », rassemblant un consortium d’académies et d’industries dont Tokyo Gas, et financé sur fonds publics, vise ainsi à construire une chaine de valeur de l’ammoniac à faible émission CO2 pour des applications carburant & électricité.
Aux États-Unis, le programme « Renewable Energy to Fuels through Utilisation of Energy-Dense Liquids” (REFUEL), financé par le Département de l’Énergie, vise quant à lui à convertir de l’énergie électrique issue de ressources renouvelables en carburants liquides à haute densité énergétique (dont l’ammoniac) pouvant à la demande restituer de l’électricité ou de l’hydrogène. L’Angleterre s’intéresse aussi à l’ammoniac (en partenariat avec Siemens) et plus spécifiquement en l’étude de comment l’énergie éolienne peut être convertie en ammoniac pour son stockage et ultérieurement restituée en énergie via un moteur à combustion interne.
En Australie, l’ammoniac est aussi investigué de manière intensive pour le stockage et la production d’énergie. Des efforts de réflexion y sont notamment menés pour diminuer l’empreinte carbone du procédé de production de l’ammoniac via la voie Haber-Bosch (Figure 2) ou en favorisant le développement des techniques d’électrolyse (Figure 3).
En Europe, les Pays-Bas sont en tête de la promotion de l’ammoniac en raison des quantités importantes de ressources renouvelables disponibles suite aux investissements privés et publics de ces dernières années. L’ammoniac apparait ainsi comme un vecteur d’énergie pour le marché domestique mais également pouvant être exporté. Des compagnies telles que NUON, Gasunie, Statoil et OCI Nitrogen évaluent actuellement la conversion de l’un des trois gazéificateurs de 440 MW de la centrale Magnum Power dans le but d’utiliser de l’hydrogène, et éventuellement de l’ammoniac, dans des super batteries qui alimenteront la centrale d’ici 2023-2030.
Les acteurs du secteur maritime étudient également l’option d’usage de l’ammoniac comme carburant pour les navires marchands avec une amélioration des options de stockage dans de grands conteneurs de navire qui, non seulement mobilisent l’ammoniac, mais peuvent également l’utiliser à des fins de ravitaillement. C-Job Naval et Proton Venture font partie d’un consortium qui recherche des possibilités de financement pour développer une nouvelle génération de super-navires capables de fonctionner à l’ammoniac d’ici 2040.
Enfin, l’Agence internationale de l’énergie (IEA), qui s’intéresse à l’utilisation de l’ammoniac pour la production d’électricité au niveau mondial, est récemment devenue un promoteur les plus actif concernant l’ammoniac, et sa production à partir de ressources renouvelables (éolienne, solaire, marémotrice, etc.). Une étude récente de l’IEA montre ainsi que l’ammoniac est beaucoup moins coûteux à stocker sur une longue période que l’hydrogène, soit 0,5 $/kg-H2 pour l’ammoniac contre 15 $/kg-H2 pour l’hydrogène sur une période de six mois, et au moins trois fois moins coûteux à expédier en mer ou sur terre.9
La recherche concernant l’ammoniac se doit donc d’être approfondie, étayée et argumentée pour se positionner de manière encore plus affirmée sur le devant de la scène énergétique internationale.
Vous souhaitez plus d’informations sur ce sujet ?
N’hésitez pas à me contacter via l’adresse email suivante: a.richel@uliege.be ou via le formulaire disponible en cliquant ici.
Notes et Références
[1] Lemay, Pierre. Berthollet découvre la composition de l’ammoniac. Dans : Revue d’histoire de la pharmacie, 48ème année, n°165, 1960, pp. 346-348.
[2] Brown, M. E.; Calvin, W. M. Evidence for Crystalline Water and Ammonia Ices on Pluto’s Satellite Charon. Science (80). 2000, 287 (5450), 107–109. https://doi.org/10.1126/science.287.5450.107. https://science.sciencemag.org/content/287/5450/107.abstract
[3] Becker, H.N., Alexander, J.W., Atreya, S.K. et al. Small lightning flashes from shallow electrical storms on Jupiter. Nature 584, 55–58 (2020). https://doi.org/10.1038/s41586-020-2532-1
https://www.nature.com/articles/s41586-020-2532-1#citeas
[4] https://agupubs.onlinelibrary.wiley.com/doi/10.1029/2002GB001862
[5] https://www.societechimiquedefrance.fr/Ammoniac.html
[6] http://www.iipinetwork.org/wp-content/Ietd/content/ammonia.html#key-data
[7] https://cen.acs.org/environment/green-chemistry/Industrial-ammonia-production-emits-CO2/97/i24
[8] Giddey, S., Badwal, S. P. S., Kulkarni, A. Review of electrochemical ammonia production technologies and materials. Int. J. Hydrogen Energy 38 (2013), 14576-14594.
[9] Valera-Medina, A., Xiao, H., Owen-Jones, M., David, W.I.F., Bowen, P. J. Ammonia for power. Prog. Energy and Combustion Sci. 69 (2018) 63-102.
[10] McKinlay, C. J., Turnock, S. R., Hudson, D.A. A comparison of hydrogen and ammonia for future long distance shipping fuels. LNG/LPG and Alternative Fuels, 29-30 janvier 2020, Londres
[11] https://www.rivieramm.com/news-content-hub/using-ammonia-as-a-fuel-for-tankers-55211
[12] https://www.frontiersin.org/articles/10.3389/fenrg.2014.00035/full
[13] https://www.energy.gov/sites/prod/files/2015/01/f19/fcto_nh3_h2_storage_white_paper_2006.pdf
[14] https://www.indexmundi.com/fr/matieres-premieres/?marchandise=gaz-naturel&mois=60
[15] https://greenammonia.org/index_eng.html